6. September 2016
Atomare Proteinkomplexstruktur der Atmungskette in Säugetieren aufgeklärt
Struktur auf atomarem Level wird Verständnis von Mutationen und daraus resultierenden Krankheiten ermöglichen
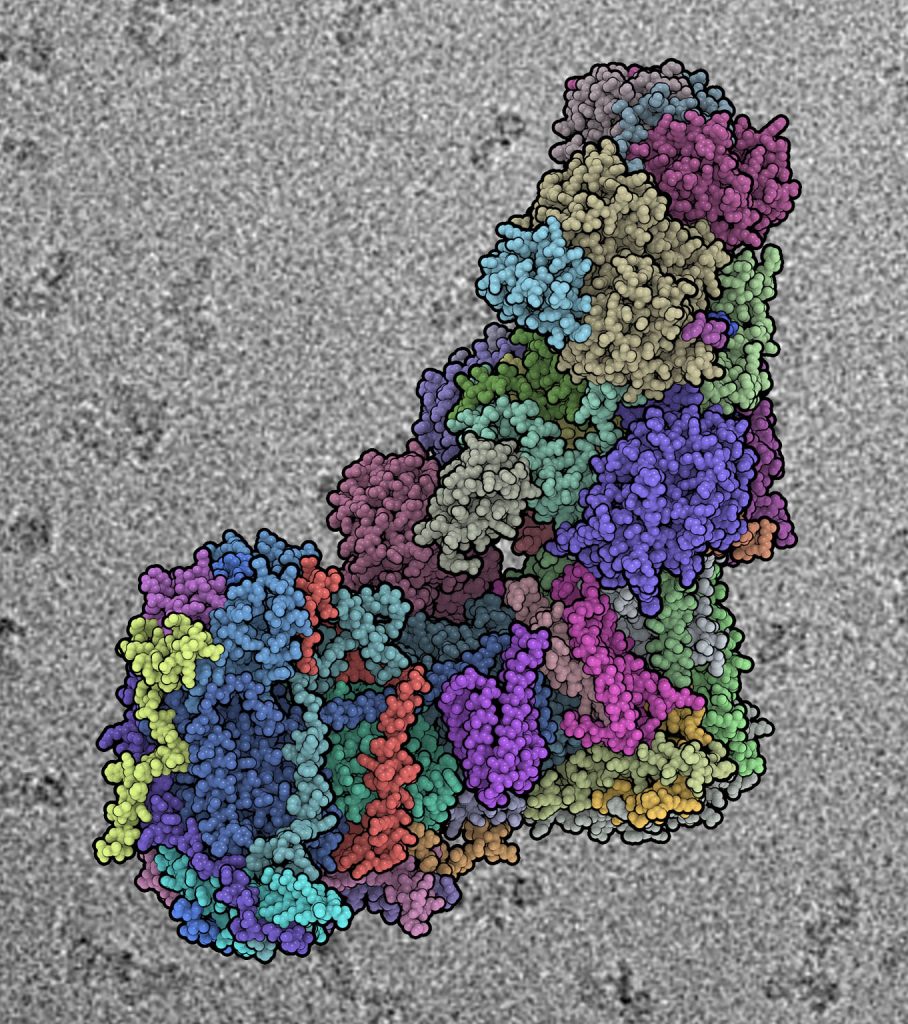
Der mitochondriale Komplex I spielt eine zentrale Rolle in Zellatmung und Energiemetabolismus. Der etwa 1 Megadalton große L-förmige Proteinkomplex ist die größte Proteingruppe der Atmungskette und nun auch der größte asymmetrische Membranproteinkomplex, dessen Struktur bisher entschlüsselt wurde. Professor Leonid Sazanov und seine Kollegen aus Großbritannien veröffentlichten nun in der Fachzeitschrift Nature die nahezu vollständige atomare Struktur des mitochondrialen Komplexes I in Zellen des Schafs mit einer Auflösung von 3,9 Å, die mittels Kryo-Elektronenmikroskopie unterstützt durch sog. Crosslinking/Massenspektrometrie-Kartierung entschlüsselt werden konnte.
Die Atmungskette, ein biochemischer Prozess, der in den Mitochondrien abläuft, ist für den Großteil der Energieproduktion im Menschen verantwortlich. Mehrere große Proteinkomplexe sind in die Lipidmembran der Mitochondrien eingebettet. Der mitochondriale Komplex I ist der erste und zugleich größte Komplex in dieser Kette. Stoffwechselprodukte unserer Nahrung werden durch diesen Enzymkomplex derart verarbeitet und leisten somit einen Beitrag zu Elektronentransfer und Protonentranslokation. Bisher konnten Forschungsgruppen vorwiegend nur Poly-Alanin-Modelle dieses Proteinkomplexes ohne der gesuchten Details auf atomaren Level darstellen, da derart große und komplexe Moleküle mit bisherigen Methoden schwer zu untersuchen waren. Durch die Kryo-Elektronenmikroskpoie und die Entwicklung von direkten Elektronendetektoren waren in den letzten Jahren große Fortschritte im hochaufgelösten Bereich möglich. Durch die Auflösung der Strukturen auf atomaren Level ist ein Verständnis der verzahnten Anordnungen und Interaktionen der 45 Untereinheiten (14 konservierte und 31 Mitochondrien-spezifische zusätzliche Einheiten) auch in Bezug auf Kopplungsmechanismen und deren Regulierung möglich. Der tiefe Einblick in Mechanismus, Zusammenbau, Reifung und Dysfunktion des Komplex I erlaubt eine detaillierte molekulare Analyse von Mutationen und veränderter Enzymaktivität, die ursächlich mit Krankheiten in Zusammenhang stehen. Daher erwarten die Forscher, dass ihre Publikation in der Fachzeitschrift Nature als Informationsquelle und Referenz in Medizin, Bioenergetik und weiteren naturwissenschaftlichen Feldern dienen wird.
Leonid Sazanov, ein Weißrussisch-Britischer Strukturbiologe, studierte Biophysik (B.Sc. und M.Sc.) an der staatlichen Weißrussischen Universität in Minsk. Nach seinem Doktorat und anschließendem Aufenthalt als Research Fellow am Department für Biophysik der Universität Moskau in der Gruppe von Sergei V. Zaitsev wechselte er and die Universität Birmingham, danach an das Imperial College in London. Am MRC Laboratory of Molecular Biology in Cambridge forschte er in der Gruppe des Nobelpreisträgers John E. Walker. Bis zu seiner Berufung ans IST Austria war er „Tenured Program Leader” in der MRC Mitochondrial Biology Unit in Cambridge. Seit April 2015 ist Lenoid Sazanov Professor am IST Austria. Seine Gruppe erforscht die Struktur und Funktion von Membranproteinen und fokussiert sich dabei auf das bessere Verständnis des Komplex I der Atmungskette.



