10. Oktober 2024
Chaos führt zur Ordnung
Wie sich aus einem Haufen scheinbar ungeordneter Zellen ein robuster Embryo entwickelt
Eine einzelne Eizelle wird befruchtet – sie startet sich kontinuierlich zu teilen. Der junge Embryo baut sich langsam zusammen. Aus dem anfänglich chaotischen Zellhaufen entstehen allmählich hoch organisierte Strukturen. Ein internationales Forschungsteam, dem auch Wissenschafter:innen des Institute of Science and Technology Austria (ISTA) angehören, hat nun neue Erkenntnisse über diesen Prozess gewonnen. Die Ergebnisse, die in Science veröffentlicht wurden, heben dabei die entscheidende Rolle von Chaos und Ordnung hervor.

Flüssigkeiten in winzige Reagenzgläser pipettieren, riesige Datensätze analysieren, Publikationen durchforsten – all diese Aufgaben gehören zum Leben eines Wissenschafter oder einer Wissenschafterin. Diese Routine heißt es jedoch hin und wieder zu durchbrechen. Eine Auszeit von der üblichen Arbeitsumgebung kann kreative Ideen hervorrufen. Tagungen beispielsweise bieten einen großartigen Rahmen für Forscher:innen sich auszutauschen und neue Kooperationen zu bilden.
Genau so war es auch bei Bernat Corominas-Murtra und Edouard Hannezo vom Institute of Science and Technology Austria (ISTA). Bei einer Postersession während eines kollaborativen Tagung in Spanien wurden Corominas-Murtra auf einen Datensatz aufmerksam. Es folgte eine lebhafte Diskussion mit dem Forscherkollegen Dimitri Fabrèges, einem Postdoc aus der Forschungsgruppe von Professor Takashi Hiiragi am Hubrecht-Institut in Utrecht, Niederlande. Aus dem Gespräch entwickelte sich schließlich eine Publikation in Science.
Das internationale Forschungsteam entwickelte einen umfassenden Atlas der frühen Morphogenese von Säugetieren – dem Prozess der Entwicklung von Form und Struktur eines Organismus. Anhand dieses Atlas analysierten die Forscher:innen, wie sich die Embryos von Maus, Hase und Affe in Raum und Zeit entwickeln. Dabei erkannten sie, dass einzelne Ereignisse wie Zellteilungen und -bewegungen sehr chaotisch sind, der Embryo als Ganzes schlussendlich jedoch immer sehr ähnlich aussieht. Mit diesem Datensatz schlagen sie ein physikalisches Modell vor, das erklärt, wie ein Säugetierembryo aus dem scheinbaren Chaos Struktur aufbaut.
Von einer zu vielen
Bei Tieren beginnt die Embryonalentwicklung mit der Befruchtung einer Eizelle. Dieses Ereignis löst eine Reihe von aufeinanderfolgenden Zellteilungen aus, die auch als Spaltungen bezeichnet werden. Kurz gesagt, eine einzelne Zelle teilt sich in zwei, aus zwei werden vier, aus vier acht und so weiter. Schließlich formt sich die Masse der Zellen zu einer sehr gut organisierten Struktur, der Blastozyste, aus der sich alle zukünftigen Organe und Gewebe entwickeln. Der gesamte Prozess wird als Morphogenese bezeichnet.
„Die frühen Schritte der Embryonalentwicklung sind von entscheidender Bedeutung, da sie die Grundlage für alle nachfolgenden Entwicklungsprozesse bilden“, erklärt Edouard Hannezo. Bei C. elegans, einem durchsichtigen Fadenwurm und dem von Entwicklungsbiolog:innen am häufigsten untersuchten Modellorganismus, zum Beispiel, sind die Teilungen im frühen Embryo extrem gut reguliert und gleich orientiert, sodass Organismen entstehen, die alle die gleiche Anzahl von Zellen haben. Bei Säugetieren hingegen scheinen die Teilungen viel zufälliger zu sein, sowohl was den Zeitpunkt als auch was die Ausrichtung betrifft. Dies wirft die Frage auf, wie eine reproduzierbare embryonale Entwicklung bei Säugetieren trotz dieser Unordnung abläuft.
Eine detaillierte Embryo-Karte
Genau dieser Frage ging die Forschungsgruppe von Takashi Hiiragi nach. Dafür betrachteten sie viele verschiedene Embryos und analysierten sie quantitativ. Mit einer sogenannten „Morphomap“ untersuchten sie die Ähnlichkeiten der Embryos von Mäusen über Hasen bis hin zu Affen, sowohl innerhalb als auch zwischen diesen Säugetierarten. Bei einer Morphomap handelte es sich um eine Karte, mit der man hochdimensionale morphologische Daten visualisieren kann. „Es ist eine Bildanalyse-Pipeline, die genau zeigt, wie sich Embryos in Zeit und Raum verhalten – quasi ein präziser Atlas der Morphogenese eines Embryos“, erklärt Hannezo.
Die Karte ermöglichte es den Wissenschafter:innen, den Entwicklungsprozess quantitativ zu analysieren und Fragen wie die Variabilität der Entwicklung zwischen den einzelnen Embryos zu beantworten. So konnten sie definieren, wie eine „normale“ Morphogenese aussieht.
Genau diese Morphomap präsentierte Fabrèges an der Tagung in Spanien. Die Daten zeigten, dass die ersten Teilungen nach der Befruchtung bei Mäusen, Hasen und Affen nicht reguliert waren. Die Zellen teilten sich wahllos, bis sie das 8-Zellen-Stadium erreichten, ein Stadium, in dem alle Embryonen plötzlich gleich aussahen. „Nachdem sie in den ersten Stadien sehr unterschiedlich aussahen, schienen sich die Embryonen am Ende des 8-Zell-Stadiums einander anzunähern“, so Hannezo weiter. Aber wie kommt das? Was bringt Struktur in dieses Chaos?
Ein embryonaler Rubik‘s Würfel – Zellcluster optimiert seine Anordnung
Die beiden theoretischen Physiker, Corominas-Murtra und Hannezo waren sofort von diesem Datensatz fasziniert und machten sich daran, diesen Prozess von einem theoretischen Standpunkt aus zu verstehen.
Die Form eines Embryos ist jedoch sehr komplex. Es ist also schwierig zu beurteilen, ob zwei Embryos ähnlich oder unterschiedlich sind. Die Wissenschafter:innen entdeckten, dass sie die gesamte Komplexität der Struktur eines Embryos allein durch die Untersuchung der Anordnung der Zellkontakte annähernd erfassen können. „Wir sind der Meinung, dass wir die meisten wichtigen Details über die Morphologie eines Embryos ableiten können, indem wir die Anordnungen der Zellen verstehen oder wissen, welche Zellen physisch miteinander verbunden sind – ähnlich wie die Verbindungen in einem sozialen Netzwerk. Dieser Ansatz vereinfacht die Datenanalyse und den Vergleich zwischen verschiedenen Embryos erheblich“, so Corominas-Murtra.
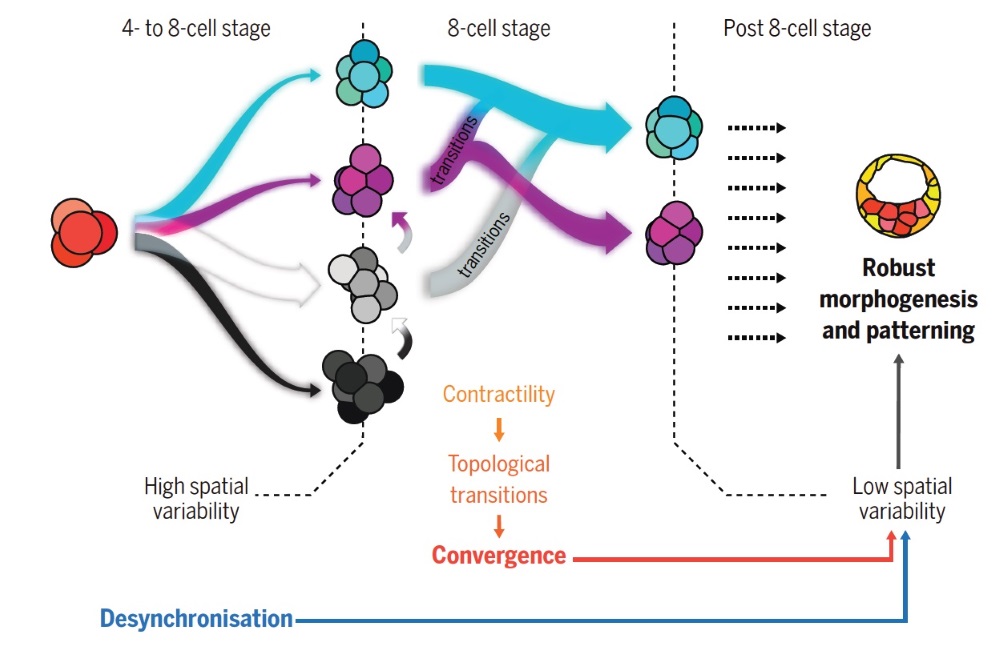
Mit dieser Information erstellten die Wissenschafter:innen ein einfaches physikalisches Modell dafür, wie Embryos zu einer reproduzierbaren Form verschmelzen. Das Modell zeigt, dass physikalische Gesetze die Embryos dazu bringen, eine bestimmte Morphologie zu bilden, die alle Säugetiere gemeinsam haben.
Diese bestimmte Form wird von physikalischen Zellinteraktion erreicht, indem sie die meisten Zellanordnungen aus dem Gleichgewicht bringen, mit Ausnahme einiger weniger, die die Oberflächenenergie des Embryos verringern. Mit anderen Worten neigen die Zellen dazu, immer mehr aneinander zu kleben. Dieser scheinbar einfache Prozess treibt den Embryo durch aufeinanderfolgende Umlagerungen tatsächlich zur optimalsten Anordnung. „Es ist, als ob Embryos ihren eigenen Rubik’s Würfel lösen“, so Corominas-Murtra.
Kein Chaos, keine Ordnung
Die Ergebnisse geben einen detaillierten Einblick in die Entwicklung von Säugetierembryos, die von Variabilität und Robustheit bestimmt wird. Ohne Chaos gibt es keine Ordnung; das eine braucht das andere. Beide sind wesentliche Bestandteile einer „normalen“ Entwicklung. „Wir haben jetzt endlich Instrumente, um die Variabilität der Morphogenese zu analysieren, die für das Verständnis der Mechanismen der Entwicklungsrobustheit entscheidend ist“, fasst Hannezo zusammen. „Der Zufall scheint eine primäre Kraft bei der Entstehung von Komplexität in der Natur zu sein“, fügt Corominas-Murtra hinzu.
Je mehr Erkenntnisse Forschende darüber gewinnen, wie das Normale aussieht, desto mehr erfahren sie auch über Anomalien. Dies kann in Bereichen wie der Krankheitsforschung, der regenerativen Medizin oder der Fruchtbarkeitsbehandlung sehr hilfreich sein. In Zukunft kann dieses Wissen dazu beitragen, den gesündesten Embryo für die In-vitro-Fertilisation (IVF) auszuwählen und so die Erfolgsquote bei der Einpflanzung zu verbessern.

Publikation:
D. Fabrèges, B. Corominas Murtra, P. Moghe, A. Kickuth, T. Ichikawa, C. Iwatani, T. Tsukiyama, N. Daniel, J. Gering, A. Stokkermans, A. Wolny, A. Kreshuk, V. Duranthon, V. Uhlmann, E. Hannezo, T. Hiiragi. 2024. Temporal variability and cell mechanics control robustness in mammalian embryogenesis. Science. DOI: 10.1126/science.adh1145
Projektförderung:
Dieses Projekt wurde durch die ISTA- Grundfinanzierung für Edouard Hannezo unterstützt.
Information zu Tierversuchen:
Um grundlegende Prozesse etwa in den Bereichen Neurowissenschaften, Immunologie oder Genetik besser verstehen zu können, ist der Einsatz von Tieren in der Forschung unerlässlich. Keine anderen Methoden, wie zum Beispiel in-silico-Modelle, können als Alternative dienen. Die Tiere werden gemäß den strengen geltenden gesetzlichen Richtlinien der jeweiligen Länder, in denen die Forschung durchgeführt wurde (Niederlande) aufgezogen, gehalten und behandelt.



