21. November 2017
Forscherteam am IST Austria definiert Funktion eines rätselhaften Synapsen-Proteins
Synaptotagmin 7 stellt Effizienz der inhibitorischen Signalübertragung sicher – Studie erschien in Cell Reports
Kommunikation ist oft von Widersprüchen geplagt – auch im Gehirn. Neurowissenschaftler am IST Austria konnten nun einen solchen Widerspruch auflösen.
In unserem Gehirn kommunizieren Nervenzellen miteinander, indem sie chemische Signale über ihre Verbindungen, die Synapsen, senden. Ein solches Signal zu senden benötigt eine hochkomplexe molekulare Maschinerie. Diese beinhaltet nicht nur das Signal selbst, also den Neurotransmitter, sondern eine ganze Bandbreite an weiteren Proteinen, die als Sensoren, Effektoren, Modulatoren und Gerüste dienen. Synaptotagmine sind ein Teil dieser komplexen Maschinerie, und es gibt sie in unterschiedlichen Varianten: 17 verschiedene sind es beim Menschen und anderen Säugetieren. Die Funktion der meisten Synaptotagmine ist allerdings noch nicht geklärt. Ein Team von NeurowissenschaftlerInnen, geleitet von Peter Jonas, Professor am Institute of Science and Technology Austria (IST Austria), hat nun geklärt, welche Rolle Synaptotagmin 7 während der Signalübertragung an einer inhibitorischen Synapse spielt. Das Team, darunter Erstautor und PhD Student Chong Chen und ForscherInnen am Max Planck Florida Institute for Neuroscience, berichtet in Cell Reports, dass Synaptotagmin 7 die Effizienz von hochfrequenter inhibitorischer Übertragung an der Synapse sicherstellt. „Die Rolle von Synaptotagmin 7 war bisher umstritten. Wir definierten zum ersten Mal seinen funktionellen Beitrag an einer inhibitorischen GABAergen Synapse“, erklärt Peter Jonas.
Widersprüchliche Rolle in der Signalübertragung
Erst im Jänner dieses Jahres zeigten Jonas und Chen, dass Synaptotagmin 2 der Kalziumsensor ist, der Synapsen schnell macht, die GABA zur Signalübertragung nutzen. In der neuen Studie wendeten sich die Forscher einem anderen Mitglied der Synaptotagmin-Familie zu, dem Synaptotagmin 7. Das Gehirn enthält eine große Menge an Synaptotagmin 7. Bisher aber konnten Forscher die Funktion des Proteins nicht definieren. Ein Grund dafür ist der Widerspruch zwischen der Funktion, die Synaptotagmin 7 auszuüben scheint, und den beobachteten Charakteristiken der Signalübertragung.
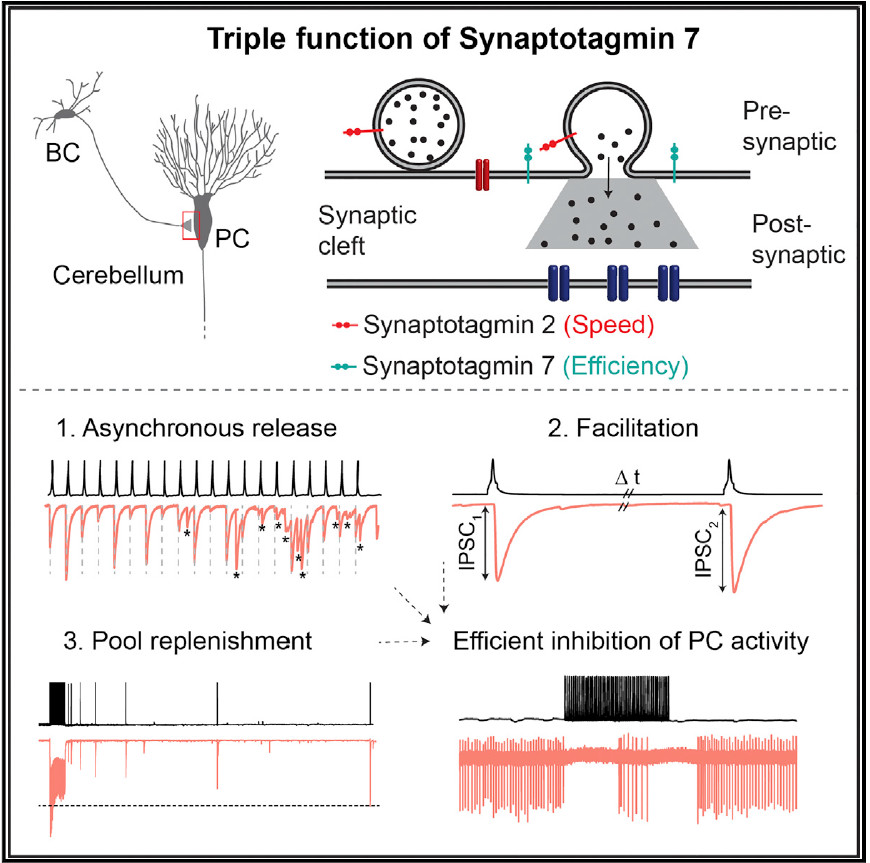
Synaptotagmin 7 scheint als Kalziumsensor zu dienen, der die Freisetzung eines langandauernden Schwalls von Neurotransmitter in den synaptischen Spalt vermittelt. Dieses Phänomen nennt man asynchrone Transmitterfreisetzung. Es gibt auch Anzeichen, dass Synaptotagmin 7 eine Rolle in der Fazilitation spielt, einer Verstärkung der Signalübertragung an der Synapse. Andererseits findet sich Synaptotagmin 7 in großen Mengen in einer Klasse von Neuronen, den schnell feuernden, Parvalbumin exprimierenden GABAergen Interneuronen. Diese Neurone bilden Synapsen, die den vorgeschlagenen Funktionen von Synaptotagmin 7 zu widersprechen scheinen: Die Synapsen setzen Neurotransmitter in einer eng synchronisierten Art frei, und nicht asynchron; außerdem zeigen sie eine Reduzierung der Neurotransmission während repetitiver Stimulierung, anstelle einer Fazilitation. In ihrer Studie lösen Chen et al. diesen scheinbaren Widerspruch auf.
Synaptotagmin 7 reguliert den Informationsfluss im Kleinhirn
Die Forscher untersuchten, wie sich die Signalübertragung verändert, wenn man Synaptotagmin 7 an einer inhibitorischen Synapse entfernt. Sie untersuchten die GABAerge Synapse zwischen Korbzellen (basket cells, BC) und Purkinjezellen (PC) im Kleinhirn, auch Zerebellum genannt: einer Gehirnregion, die für die motorische Kontrolle notwendig ist. Sie zeigen, dass Synaptotagmin 7 tatsächlich zur asynchronen Transmitterfreisetzung, zum Nachschub von mit Transmitter gefüllten Vesikeln, und zur Fazilitation beiträgt. Aber diese drei Funktionen schließen einander nicht gegenseitig aus, sondern bestehen an BC-PC Synapsen nebeneinander. Sorgfältige Analysen waren notwendig, um die Wirkungen von Synaptotagmin 7 zu entschlüsseln, da die asynchrone Transmitterfreisetzung gering ist und Fazilitation von synaptischer Hemmung (Depression) überlagert wird. Die Autoren konnten schließlich einen wesentlichen Unterschied im Ausmaß der Depression nachweisen. Wenn Synaptotagmin 7 vorhanden ist, ist die Depression nur gering; ist Synaptotagmin 7 nicht vorhanden, ist die Depression wesentlich größer. Daher stellt Synaptotagmin 7 die effiziente und frequenz-unabhängige Signalübertragung an der BC-PC Synapse sicher, eine ihrer grundlegenden Eigenschaften.
Auf der Ebene der neuronalen Netzwerke fanden die Forscher, dass Synaptotagmin 7 es einzelnen Korbzellen erlaubt, die Aktivität einer Purkinjezelle zu kontrollieren. Diese Neurone sind die einzigen, die Information aus dem Kleinhirn nach außen senden. Synaptotagmin 7 hat also eine strategische Position inne, um den Informationsfluss in diesem motorischen Schaltkreis zu regulieren. Die Forscher fanden außerdem, dass Synaptotagmin 7 eine ähnliche, allerdings quantitativ geringere, Rolle an GABAergen Synapsen im Hippokampus spielt. Diese Gehirnregion mit der Form eines Seepferdchens spielt eine Rolle bei räumlicher Kodierung und beim Lernen. Peter Jonas fasst zusammen: „Wir haben herausgefunden, dass Synaptotagmin 7 eine wichtige Rolle dabei spielt, die Effizienz der Übertragung an GABAergen Synapsen im Kleinhirn und Hippokampus sicherzustellen.“
Biographien der Autoren
Peter Jonas will die Funktion von neuronalen Mikroschaltkreisen verstehen. Seine Forschungsgruppe untersucht quantitativ die Mechanismen der synaptischen Signalübertragung an inhibitorischen Synapsen, die GABA freisetzen. Peter Jonas erhielt unter anderem den Wittgenstein Preis 2016, zwei ERC Advanced Grants und den Gottfried Wilhelm Leibniz Preis. Er ist Mitglied der Academia Europaea und der Deutschen Akademie der Naturforscher Leopoldina. Peter Jonas forscht seit 2010 am IST Austria. Chong Chen ist ein PhD Student in der Gruppe von Peter Jonas. Er studiert seit 2014 im interdisziplinären PhD-Programm des IST Austria. Zuvor studierte er Medizin an der School of Medicine, Shanghai Jiaotong University.
Publikation
Chen, Chong et al. 2017. Triple function of synaptotagmin 7 ensures efficiency of high-frequency transmission at central GABAergic synapses. Cell Reports. DOI: 10.1016/j.celrep.2017.10.122