27. März 2024
Die Protein Fabrik
Neuer Assistenzprofessor am ISTA stellt 3D-Nanomoleküle her
Mit Florian Praetorius begrüßt das Institute of Science and Technology Austria (ISTA) einen neuen Assistenzprofessor. Seine Expertise: die Herstellung von gänzlich neuen Proteinen. Dafür verbindet er Biochemie, molekulare Biologie, Physik und Computerwissenschaften. Die fertigen Proteine könnten unter anderem dazu verwendet werden, um die Entwicklung von Impfstoffen voranzutreiben.

Florian Praetorius spaziert durch einen langen, hellen Flur im Moonstone Building, dem neuesten Gebäude auf dem Campus des Institute of Science and Technology Austria (ISTA). Er blickt in sein Labor, das gerade nach seinen Bedürfnissen fertiggestellt wird. „In Kürze wird das Labor mit Labortischen und Geräten gefüllt sein und ein hoch motiviertes sowie dynamisches Team an Wissenschafter:innen beherbergen“, so Praetorius vorfreudig. Hier werden Biochemiker:innen, Molekularbiolog:innen, Physiker:innen und Informatiker:innen gemeinsam Biomoleküle designen – eine wahre „Proteinfabrik“.
Proteine wie am Fließband herstellen
„Wir entwickeln völlig neue Proteine, mit Eigenschaften, die in der Natur nicht vorkommen“, erklärt Praetorius. Wie auch bei herkömmlichen Designprozessen benötigt es dafür Kreativität, Präzision und die Kenntnis grundlegender naturwissenschaftlicher Prinzipien aus verschiedensten Bereichen.
Zunächst müssen die Forscher:innen die Struktur des gewünschten Proteins entwerfen und vorhersagen. Dazu verwenden sie Computer- und Deep-Learning-Tools. Dann gehen sie zum experimentellen Teil über, bei dem Bakterien als Kraftwerk eingesetzt werden, ähnlich wie automatisierte Maschinen in einer Fabrik. Durch die Modifizierung von Bakterien können diese Mikroorganismen das gewünschte Protein als Teil ihrer regulären zellulären Prozesse herstellen. Im nächsten Schritt wenden die Forscher:innen dann biochemische Verfahren an, um die Proteine zu isolieren, zu reinigen und zu charakterisieren – eine Art Qualitätskontrolle.
Ein besonderes Augenmerk der Praetorius Gruppe liegt auf Proteinen, die zwischen zwei Formen wechseln können. Diese Änderungen können mit bestimmten Inputs und Outputs verknüpft sein. „Der Input kann ein beliebiger Stimulus sein, z. B. Licht, während sich der Output als Änderung der Funktion manifestieren kann“, erläutert der Biochemiker. Natürliche Proteine nehmen solche Zustandsänderungen häufig an, um ihre biologische Funktion zu erfüllen. Sie zu konstruieren, ist jedoch sehr schwierig. 2023 gelang es Praetorius und seinen Kolleg:innen, eine Reihe von Proteinen zu entwerfen, die reversibel zwischen zwei Zuständen hin- und herschalten können. Ihre Kreationen, sogenannte „Scharnier“-Proteine (aus dem Englischen „hinge proteins“), nehmen einen bestimmten Zustand ein, wenn kein Bindungspartner vorhanden ist, und einen zweiten, wenn sie an ein Partnermolekül gekoppelt sind.
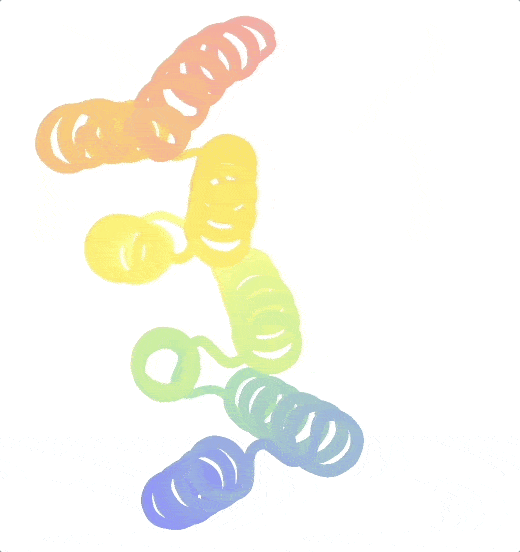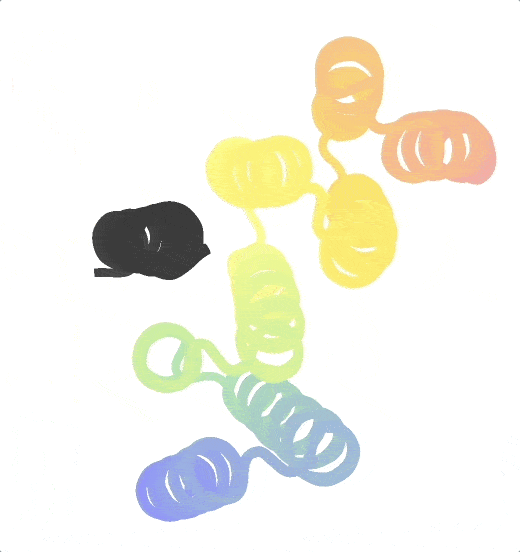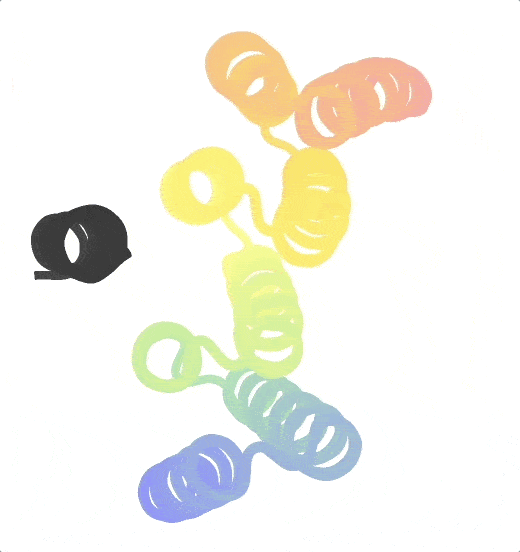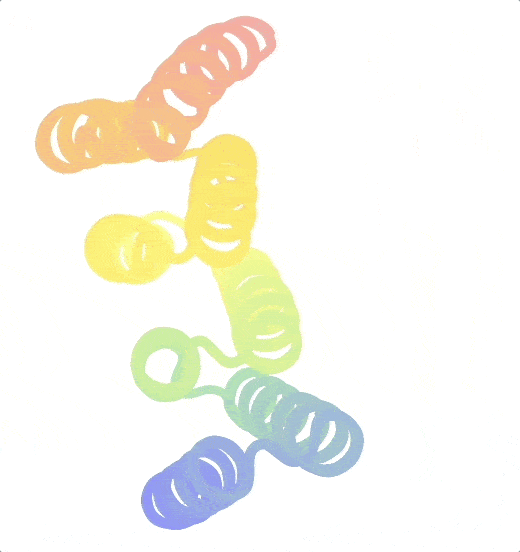
Origami in der Wissenschaft
Neben der Herstellung von Proteinen beschäftigt sich die Forschungsgruppe von Praetorius auch mit Origami – genauer gesagt mit DNA-Origami. Ähnlich der subtilen und filigranen Kunst, Papier in verschiedene Formen zu falten, nehmen die Wissenschafter:innen DNA-Stränge und biegen sie in präzise, dreidimensionale Strukturen im Nanomaßstab. Diese werden dann in die von ihnen hergestellten Proteine integriert, um größere Komplexe herzustellen. „Ein typisches Protein ist nur ein paar Nanometer groß. Um etwas zu konstruieren, das sich über 100 Nanometer erstreckt, müsste man viele Proteine zusammensetzen. Das ist sehr mühsam“, erklärt Praetorius. „Unsere DNA-Strukturen können diese Längenskalen überbrücken, ohne die Eigenschaften des Proteins zu verändern. Letztendlich ist es unser Ziel, Ansätze aus dem computergestützten Proteindesign und der DNA-Nanotechnologie zu kombinieren, um DNA-Protein-Hybridverbindungen zu erzeugen, die das Beste aus beiden Welten vereinen.“
Technologie und Zusammenarbeit vorantreiben
Solche Molekülkomplexe haben viele Anwendungsmöglichkeiten. So können sie zum Beispiel als Antikörper oder Enzyme in therapeutischen Kontexten, aber auch bei der Entwicklung von Impfstoffen eingesetzt werden. Wenn ein Virus versucht, Zellen im menschlichen Körper zu infizieren, erkennt er bestimmte Muster auf der Oberfläche der Zelle. Proteine können so konzipiert werden, dass sie an diese Muster binden und so die Anheftung des Virus blockieren. „Bis dorthin ist es ein weiter Weg“, so Praetorius. „Grundsätzlich glaube ich aber, dass die Erweiterung der Technologie zu neuen Anwendungen und Vorteilen führen wird.“ Zudem sind diese Nanomoleküle auch für Forscherkolleg:innen am ISTA und darüber hinaus wertvoll. „Für unsere Innovationen gibt es hier viele potenzielle Nutzer:innen, und ich freue mich schon auf diese Kooperationen. Es wäre großartig, wenn wir ein Tool entwickeln könnten, welches jemandem bei der Beantwortung einer bestimmten Frage hilft“, erklärt Praetorius.
Von Deutschland über die USA ans ISTA
Aufgewachsen in Freiburg (Deutschland) promovierte Florian Praetorius an der Technischen Universität München in Physik. Anschließend arbeitete er sechs Jahre lang als Postdoc im renommierten Baker-Lab in Seattle an der University of Washington, USA, wo er das Handwerk des Designs von Biomolekülen erlernte. Die Entscheidung, nach Klosterneuburg zu kommen, ist ihm leichtgefallen. „Was mir am ISTA besonders gefällt ist die Organisationsstruktur, die überschaubare Gruppengröße, das Konzept der wissenschaftlichen Services (Scientific Service Units, SSUs), welche Fachwissen und Geräte in gemeinsamen Einrichtungen bereitstellen, sowie die interdisziplinäre Atmosphäre“, betont er. „In einem traditionelleren Umfeld wüsste ich nicht, in welche Abteilung meine Arbeit am besten passt.“ Mit einem ERC-Starting Grant in der Tasche schlägt er nun ein neues Kapitel am ISTA auf.



