9. Januar 2020
„Flash and freeze“ verrät die Dynamik von Nervenverbindungen
Neue Methode zur gleichzeitigen Untersuchung von Struktur und Funktion von Synapsen in intakten Gehirnschaltkreisen von Mäusen vorgestellt - Studie in Neuron erschienen
© Carolina Borges Merjane
Wie ermöglichen es die physischen Bestandteile eines Neurons, Information zu verarbeiten und zu kommunizieren? Die Beziehung zwischen Struktur und Funktion zu verstehen ist ein entscheidendes Fernziel in den Neurowissenschaften. In der neuesten Ausgabe des Fachmagazins Neuron berichtet die Gruppe von Peter Jonas, Professor am Institute of Science and Technology Austria (IST Austria), über eine neuartige Methode, um dieses Ziel zu erreichen.
Struktur und Funktion von Synapsen gleichzeitig zu untersuchen ist eine Herausforderung: Funktion wird im lebenden Gewebe erforscht, indem elektrische Signale mittels Elektrophysiologie im Millisekundenbereich gemessen werden; die Beobachtung von kleinsten Strukturen im Nanometerbereich erfordert dagegen die Vorbereitung von Gewebe für die Elektronenmikroskopie. Peter Jonas und die beiden Erstautorinnen, Carolina Borges-Merjane (Postdoc) und Olena Kim (Doktorandin), entwickelten daher eine so genannte „flash and freeze“-Methode zur Untersuchung von Struktur und Funktion von Synapsen in intakten neuronalen Schaltkreisen in Gewebeschnitten des Gehirns von Säugetieren.
Verfahren macht strukturelle Veränderungen während der neuronalen Kommunikation sichtbar
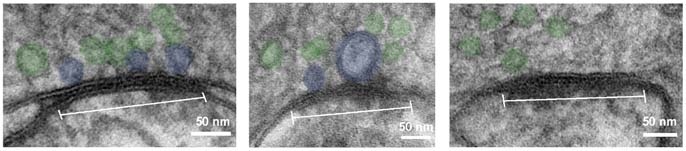
Der Name „Flash and freeze“ bezieht sich auf den Lichtblitz, der die Neuronen stimuliert. Diesem folgt das sofortige Einfrieren des Gewebes, um es in seinem ursprünglichsten Zustand zu fixieren. Professor Jonas fasst die Herausforderung zusammen: „Wir machen in unserem Labor meist unmögliche Experimente, und dieser neue Forschungsansatz fällt genau in diese Kategorie. Hier nehmen wir eine Synapse, stimulieren sie mit Licht und schießen sie innerhalb von Millisekunden in eine Kammer, die die Struktur bei minus 196 Grad Celsius und einem Druck von 2000 bar einfriert.“ Die Probe fällt dann in einen Tank mit flüssigem Stickstoff und wird für die elektronenmikroskopische Analyse vorbereitet.
Mit diesem Aufbau können die NeurowissenschafterInnen Neurone stimulieren und das Gewebe unmittelbar danach für die elektronenmikroskopische Analyse einfrieren, so dass Veränderungen der Anatomie direkt nach der Stimulation sichtbar werden. „Es ist eine sehr dynamische Art, Synapsen zu untersuchen“, erklärt Carolina Borges-Merjane, „wir können die Neurone mit Licht stimulieren und dann sofort einfrieren. Wir können aber auch einige Millisekunden oder sogar Sekunden warten. Durch mehrere solcher Momentaufnahmen können wir zeigen, wie sich die synaptischen Strukturen verändern, während ein Signal an der Synapse übertragen wird“, erklärt Carolina Borges-Merjane. In einer parallelen Reihe von elektrophysiologischen Experimenten im lebenden Gewebe charakterisierten die ForscherInnen die funktionelle Dynamik desselben Synapsentyps. Durch die Integration dieser Datensätze zeigen sie, wie strukturelle Veränderungen die beobachtete Funktion hervorrufen.
Funktion bleibt in intakten Netzwerken erhalten
Die von der Jonas-Gruppe vorgestellte Methode ist eine Modifikation des „flash and freeze“-Protokolls, das ursprünglich für die Untersuchung von Neuronen des Wurms Caenorhabditis elegans und von einzelnen isolierten oder dissoziierten Säugetier-Neuronen verwendet wurde. Der Unterschied: Die neu vorgestellte Methode verwendet Schnitte des Maushirns, in denen die neuronalen Netzwerke weitgehend intakt und lebendig bleiben. „Die Funktion von Neuronen wird in der Regel in Schnitten von Hirngewebe untersucht, in denen die Netzwerke intakt sind. Die synaptische Struktur wird typischerweise in chemisch fixierten Proben oder, wie bisher mit Flash und Freeze, mit dissoziierten Neuronen untersucht. Mit unserer Methode können wir nun die gleiche Art von Präparat verwenden, mit dem die synaptische Funktion erforscht wird, um gleichzeitig die Struktur zu untersuchen“, betont Olena Kim. Die AutorInnen zeigten auch, dass die Methode auf verschiedene Hirnregionen anwendbar ist und daher bei Studien an verschiedenen Synapsen im Gehirn eingesetzt werden kann.
Strukturell und funktional definierte Vesikel-Pools als nahezu ident erwiesen
In einem Proof-of-Principle-Experiment analysierten die ForscherInnen Vesikelpools an einer kortikalen Synapse. Diese Vesikel enthalten die Neurotransmitter, welche die Signale an das benachbarte Neuron übertragen. Die ForscherInnen stellten fest, dass der strukturell definierte „angedockte“ Pool und der funktionell definierte „leicht freisetzbare Pool“ synaptischer Vesikel bei Betrachtung und Analyse mit ihrer neuen integrierten Methode tatsächlich nahezu identisch sind. „Dies wurde noch nie direkt nachgewiesen. Wir interpretieren unsere Ergebnisse so, dass die Vesikel mit der Plasmamembran verschmelzen und sich in sie integrieren“, erklärt Jonas. „Unser Ergebnis unterstreicht, wie wichtig es ist, die gleichzeitige Untersuchung von Struktur und Funktion auf kortikale Schaltkreise auszudehnen.“
Publikation
Carolina Borges-Merjane, Olena Kim & Peter Jonas. 2020. Functional electron microscopy (“flash and freeze”) of identified cortical synapses in acute brain slices. Neuron. DOI: 10.1016/j.neuron.2019.12.022
Förderinformation
Dieses Projekt wurde durch Mittel des European Research Council (ERC) und der Europäischen Kommission unter dem Horizon 2020 Forschungs- und Innovationsprogramm der Europäischen Union (ERC grant agreement no 692692 und Marie Sklodowska-Curie 708497) sowie des Fonds zur Förderung der Wissenschaftlichen Forschung ((Z 312-B27 Wittgenstein Preis und DK W 1205-B09) ermöglicht.
Tierwohl
Um zu verstehen, wie das menschliche Gehirn Information abspeichert und verarbeitet, ist es unumgänglich das Gehirn von Tieren während bestimmter Verhaltensweisen zu untersuchen. Keine anderen Methoden, wie z. B. in vitro oder in silico-Modelle, stehen hierfür als Alternative zur Verfügung. Die Tiere wurden gemäß der strengen in Österreich geltenden gesetzlichen Richtlinien aufgezogen, gehalten und behandelt.



