12. August 2024
Korrekt ausrichten oder sterben
ISTA-Forscher:innen entdecken, wie sich ‚sterbliche Fäden‘ selbstorganisieren
‚Sterben für die Ausrichtung‘ ist das Motto eines bisher unbekannten Mechanismus der Selbstorganisation aktiver Materie, der für die bakterielle Zellteilung wesentlich ist. Falsch ausgerichtete Fäden ‚sterben‘ spontan, damit sich im Zentrum der sich teilenden Bakterienzelle eine klar organisierte Ringstruktur bildet. Die Studie, die von der Šarić Gruppe am Institute of Science and Technology Austria (ISTA) geleitet wurde, ist jetzt in Nature Physics veröffentlicht. Die Arbeit könnte bei der Entwicklung synthetischer selbstheilender Materialien Anwendung finden.
Wie kann sich Materie – per Definition leblos – selbst organisieren und uns lebendig machen? Eines der Markenzeichen des Lebens, die Selbstorganisation, sind spontane Bildung und Abbau biologisch aktiver Materie. Da Moleküle jedoch ständig ’ins Leben gerufen werden‘ und wieder ‚sterben‘, kann man sich fragen, woher sie ‚wissen‘, wo, wann und wie sie sich zusammenfügen – und wann sie aufhören und auseinanderfallen sollen.
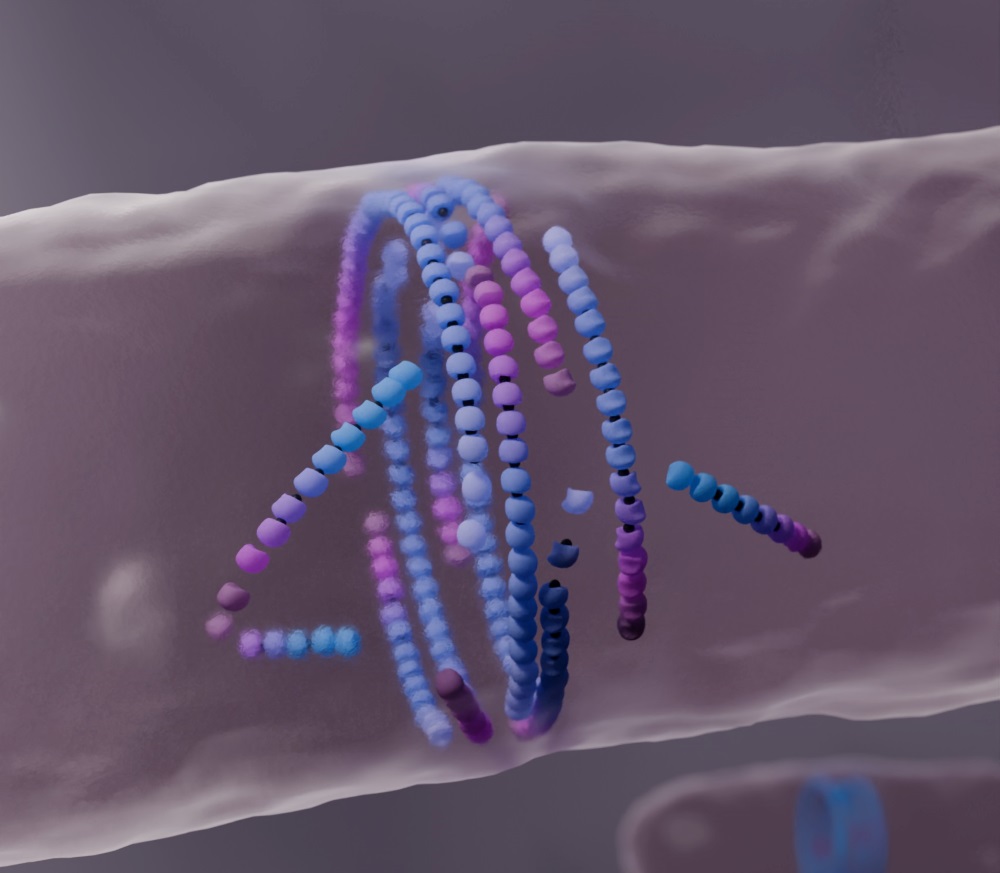
Forscher:innen um Professorin Anđela Šarić und PhD-Student Christian Vanhille Campos am Institute of Science and Technology Austria (ISTA) gehen diesen Fragen im Kontext der bakteriellen Zellteilung nach. Dafür entwickelten sie ein Berechnungsmodell, das zeigt, wie sich Fäden eines Moleküls namens FtsZ, zusammenbauen. Dieses ist ein Beispiel für aktive Materie. Während der Zellteilung baut sich aus FtsZ eine Ringstruktur im Zentrum der sich teilenden Bakterienzelle. Dieser FtsZ-Ring – der als bakterieller Teilungsring bezeichnet wird – trägt zur Bildung einer neuen ‚Wand‘ bei, die die Tochterzellen voneinander trennt. Wesentliche physikalische Aspekte des FtsZ-Selbstaufbaus sind jedoch bis heute nicht geklärt. Nun taten sich Berechnungsmodellierer:innen aus der Šarić Gruppe zusammen mit Biolog:innen aus der Gruppe von Séamus Holden an der University of Warwick im Vereinigten Königreich, und der Gruppe von Martin Loose am ISTA, um einen unerwarteten Selbstaufbaumechanismus aufzudecken. Ihre Berechnungen zeigen, wie falsch ausgerichtete FtsZ-Filamente reagieren, wenn sie auf ein Hindernis treffen. Indem sie ‚sterben‘ und sich neu zusammensetzen, begünstigen sie die Bildung des bakteriellen Teilungsrings, einer gut ausgerichteten Fadenstruktur. Diese Erkenntnisse könnten bei der Entwicklung synthetischer selbstheilender Materialien Anwendung finden.
‚Treadmilling‘, die adaptive Kraft des molekularen Umsatzes
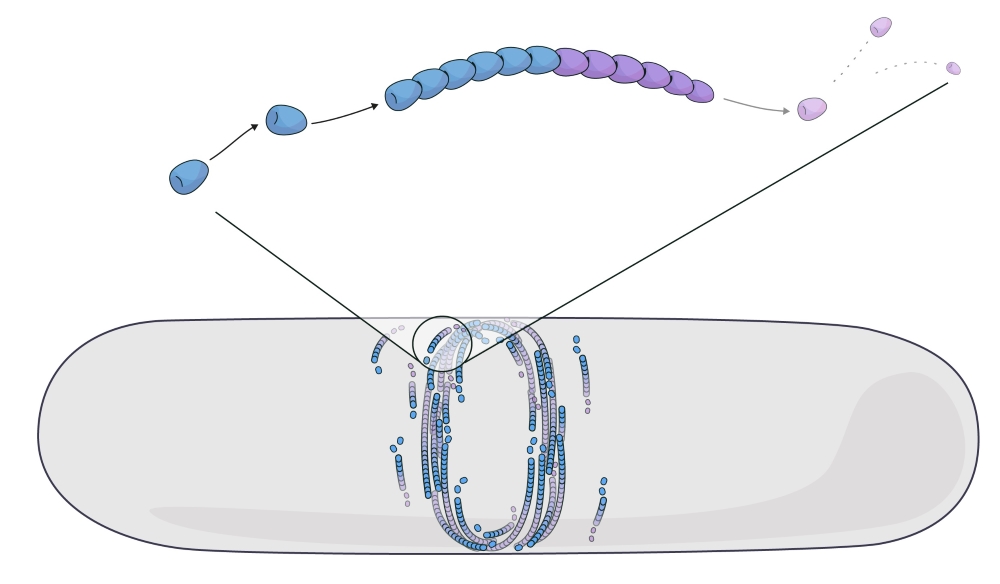
FtsZ bildet Proteinfäden, die sich durch ständiges Wachsen und Schrumpfen selbst zusammensetzen. Dieser als ‚Treadmilling‘ (bzw. Tretmühlenmechanismus) bezeichnete Prozess besteht aus dem laufenden Hinzufügen und Entfernen von Untereinheiten an gegenüberliegenden Enden der Fäden. Es wurde nachgewiesen, dass mehrere Moleküle in verschiedenen Lebensformen – wie Bakterien, Tieren oder Pflanzen – sich auf diese Art und Weise selbstorganisieren. Wissenschafter:innen haben das Treadmilling bisher als eine Form des Selbstantriebs betrachtet und es als Filamente modelliert, die sich vorwärts bewegen. Solche Modelle erfassen jedoch nicht den ständigen Umsatz der Untereinheiten. Außerdem überschätzen diese Modelle die Kräfte, die durch den Zusammenbau der Molekül-Fäden entstehen. Daher entschlossen sich Anđela Šarić und ihr Team, zu modellieren, wie FtsZ-Untereinheiten interagieren und sich durch Treadmilling selbstorganisieren. „Alles in unseren Zellen befindet sich im ständigen Umsatz. Daher müssen wir anfangen, biologisch aktive Materie aus diesem Blickwinkel zu betrachten, wie sie sich durch molekularen Umsatz an die äußere Umgebung anpasst“, sagt Šarić.
Sterbliche Fäden: Sterben, um sich auszurichten
Was sie fanden, war verblüffend. Im Gegensatz zu selbstangetriebenen Fäden, die die umgebenden Moleküle anschieben und eine ‚Beule‘ verursachen, stellten sie fest, dass falsch ausgerichtete FtsZ-Filamente zu ‚sterben‘ beginnen, wenn sie auf ein Hindernis treffen. „Aktive Materie, die aus sterblichen Filamenten besteht, nimmt Fehlausrichtungen nicht auf die leichte Schulter. Wenn ein Filament wächst und mit Hindernissen kollidiert, löst es sich auf und stirbt“, sagt der Erstautor Vanhille Campos. Šarić fügt hinzu: „Unser Modell zeigt, dass der Treadmilling-Mechanismus zu einer lokalen Heilung des aktiven Materials führt. Wenn sich falsch ausgerichtete Filamente auflösen, tragen sie letzten Endes zu einer besseren Gesamtanordnung bei.“ Indem sie die Zellgeometrie und die Filamentkrümmung in ihr Modell einbezogen, konnten die Forschenden zeigen, wie das Auflösen von falsch ausgerichteten FtsZ-Filamenten zur Bildung des bakteriellen Teilungsrings beiträgt.
Theoriebasierte Forschung, bestätigt durch die Zusammenarbeit mit angewandten Biolog:innen
Angetrieben von den physikalischen Theorien molekularer Wechselwirkungen trafen Šarić und ihr Team bald darauf auf zwei unabhängige Forschungsgruppen, die ihre Ergebnisse anhand von Experimenten bestätigen konnten. Auf einer multidisziplinären Konferenz mit dem Titel ‚Physics Meets Biology‘ traf Šarić auf Séamus Holden, der die bakterielle Ringbildung in lebenden Bakterien erforscht. Holden präsentierte dort spannende experimentelle Daten, die zeigten, dass das Auflösen und die Entstehung von FtsZ-Filamenten für die Bildung des Teilungsrings wesentlich sind. Dies deutete darauf hin, dass das Treadmilling eine entscheidende Rolle in diesem Prozess spielt. „Erfreulicherweise haben wir festgestellt, dass sich die FtsZ-Ringe in unseren Simulationen genauso verhalten wie die Teilungsringe von Bacillus subtilis, die das Team von Holden mithilfe von Mikroskopie-Techniken nachweisen konnte“, sagt Vanhille Campos.
Ein ähnlicher Glücksfall war der Wechsel vom University College London zum ISTA, der es Šarić und ihrer Gruppe ermöglichte, mit Martin Loose zusammenzuarbeiten, der am ISTA am Zusammenbau von FtsZ-Filamenten in einem kontrollierten in vitro Versuchsaufbau gearbeitet hatte. Sie sahen, dass die In-vitro-Ergebnisse eng mit den Simulationen übereinstimmten, was die Berechnungsergebnisse des Teams weiter bestätigte. Šarić unterstreicht den Geist der Zusammenarbeit und die Synergie zwischen den drei Gruppen: „Wir gehen alle über unsere üblichen Forschungsbereiche hinaus. Wir diskutieren offen und tauschen Daten, Ansichten und Wissen aus, was es uns ermöglicht, Fragen zu beantworten, die wir nicht getrennt angehen können.“
Auf dem Weg zu synthetischen selbstheilenden Materialien
Die energiegetriebene Selbstorganisation von Materie ist ein grundlegender Prozess in der Physik. Das Team unter der Leitung von Šarić geht nun davon aus, dass FtsZ-Filamente eine andere Art von aktiver Materie sind, die Energie eher in den Umsatz der Einzeleinheiten als in die Beweglichkeit der Fäden investiert. „In meiner Gruppe fragen wir uns, wie man lebende Materie erzeugen kann aus nicht-lebendem Material, das lebendig aussieht. Unsere jetzige Arbeit könnte also in Zukunft die Schaffung von synthetischen selbstheilenden Materialien oder synthetischen Zellen erleichtern“, sagt Šarić. In einem nächsten Schritt wollen Šarić und ihr Team modellieren, wie der bakterielle Teilungsring dabei hilft, eine ‚Teilungswand‘ zu bilden. Holden und Šarić werden diese Frage mit Hilfe einer kürzlich vom Wellcome Trust gewährten Förderung in Höhe von 3,7 Millionen Euro weiter erforschen.
Publikation:
Vanhille Campos, C. et al., 2024. Self-organisation of mortal filaments and its role in bacterial division ring formation. Nature Physics. DOI: 10.1038/s41567-024-02597-8
Funding information:
Dieses Projekt wurde durch Mittel der Royal Society (Grant No. UF160266), des Horizon 2020 Forschungs- und Innovationsprogramms der Europäischen Union (ERC Starting Grant No. 802960), des Österreichischen Wissenschaftsfonds (FWF) StandAlone P34607, des Wellcome Trust und der Royal Society Sir Henry Dale Fellowship (Grant No. 206670/Z/17/Z) finanziert.



