23. Juli 2020
Typsache: Zellen reagieren unterschiedlich auf genomische Prägung
Genomische Prägung steuert den Überlebensvorteil von Astrozyten – Studie in Neuron erschienen

© The Art Institute of Chicago
Bekanntlich erben wir eine Hälfte unserer Gene von der Mutter, die andere Hälfte vom Vater. Für die Funktion der allermeisten Gene ist es gleichgültig, von welchem Elternteil sie stammen. Doch das gilt nicht für alle Gene: Rund 150 Gene, die der „genomischen Prägung“ unterliegen, sind entweder nur aktiv, wenn sie von der Mutter geerbt wurden, oder nur aktiv, wenn sie vom Vater geerbt wurden, je nach Gen. Die meisten dieser „geprägten“ Gene sind wichtig für unsere Entwicklung. Simon Hippenmeyer, Professor am Institute for Science and Technology Austria (IST Austria), und seine Forschungsgruppe, darunter Postdoc Susanne Laukoter und Senior Laboratory Technician Florian Pauler, zeigten nun, dass Gehirnzellen je nach Zelltyp äußerst unterschiedlich auf genomische Prägung reagieren. Das ist das Ergebnis einer Studie an Mäusen, die im Fachjournal Neuron erscheint.
Frühere Studien zeigten, dass geprägte Gene in manchen Geweben stärker aktiv sind, in anderen hingegen weniger. Die NeurowissenschafterInnen rund um Hippenmeyer fanden, dass auch im Kortex, der Großhinrinde, geprägte Gene in manchen Zelltypen stärker exprimiert werden, also aktiver sind, als in anderen Zelltypen.
Die einzelne Zelle im Blick
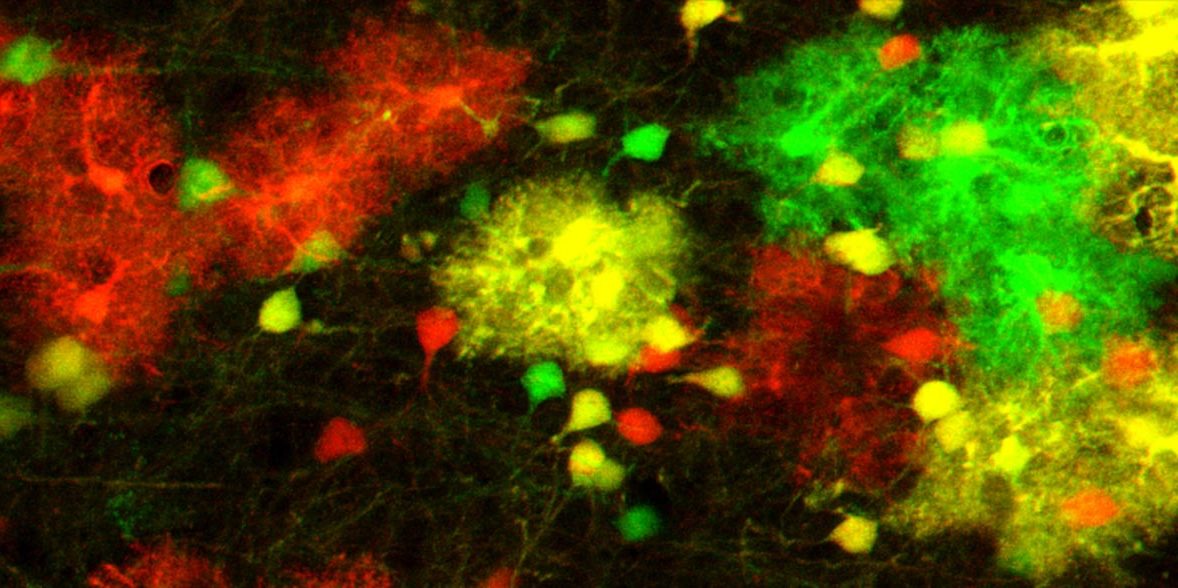
Um zu untersuchen, welchen Effekt diese unterschiedliche Genaktivität hat, wandten die ForscherInnen die von Hippenmeyer etablierte MADM-Technik an. „Mit dieser Technik können wir Zellen farblich markieren und gleichzeitig den Expressionslevel der Gene hinauf- oder hinunterschrauben“, erklärt Susanne Laukoter. „In unseren Experimenten verdoppelten wir die Expression geprägter Gene in manchen Zellen, in manchen schalteten wir sie komplett aus. Wir konnten so auf Einzelzell-Ebene beobachten, wie Zellen auf die Veränderung der Gendosis reagieren.“
So stellten die ForscherInnen fest, dass Zellen auf die Dosisveränderung von geprägten Genen reagieren, indem sie bestimmte Gengruppen aktivieren – insbesondere Gengruppen, die für Zelltod, Wachstum und die Entwicklung von Synapsen wichtig sind. Am stärksten fiel diese Antwort im Zelltyp der Astrozyten aus, einer Form von Gliazellen, die die Nervenzellen unterstützen.
Eine genaue Analyse der Astrozyten zeigte, dass Astrozyten mit einer doppelten Dosis einiger väterlichen Gene immer in höherer Zahl vorhanden sind als Astrozyten mit einer doppelten Dosis der entsprechenden mütterlichen Gene. Dieser Unterschied zog sich durch die gesamte Gehirnentwicklung durch. „Entweder schützt die genomische Prägung Zellen mit einer doppelten väterlichen Gendosis vor dem Zelltod, oder die doppelte mütterliche Gendosis beschleunigt den Zelltod“, erläutert Florian Pauler.
Möglicherweise für Syndrome des Menschen relevant
Frühere Studien legten bereits eine Verbindung zwischen genomischer Prägung und Zelltod nahe, die neu erschienene Studie zeigt nun, dass diese Verbindung vom Zelltyp abhängt und in Astrozyten besonders stark ist. Neuronen mit einer doppelten Anzahl an mütterlichen Genen reagierten nicht mit Zelltod, stattdessen bildeten sie andere Verknüpfungen und Netzwerke. „Jeder Zelltyp reagiert unterschiedlich auf die Disomie, also das Vorhandensein von zwei mütterlichen oder zwei väterlichen Genen“, erklärt Simon Hippenmeyer das Ergebnis. Das kann auch für Menschen wichtig sein. „Das Prader-Willi-Syndrom und das Angelman-Syndrom werden von einer Verdopplung eines genomisch geprägten Chromosomen-Abschnitts verursacht. Jedes Organ reagiert unterschiedlich auf die Verdopplung. Wenn wir die Zelltyp-spezifische Reaktion besser verstehen, kann eine gezielte Therapie in Zukunft hoffentlich möglich werden.“
Die Studie löst auch eine langjährige Debatte in der Neurobiologie darüber, wie viele Gene im Gehirn genomisch geprägt sind, berichtet Hippenmeyer. „Ein paar Dutzend Gene in der Großhirnrinde sind genomisch geprägt und beeinflussen signifikant die Entwicklung.“
Publikation
Susanne Laukoter, Florian M. Pauler, Robert Beattie, Nicole Amberg, Andi H. Hansen, Carmen Streicher, Thomas Penz, Christoph Bock & Simon Hippenmeyer. Cell-Type Specificity of Genomic Imprinting in Cerebral Cortex. Neuron. DOI: 10.1016/j.neuron.2020.06.031
Förderungsinformation
Die Forschung, die zu diesen Ergebnissen führt, wurde von der Österreichischen Akademie der Wissenschaften (DOC Fellowship 24812), dem FWF Österreichischer Wissenschaftsfonds (FWF Firnberg-Programm T 1031, FWF Meitner-Programm M 2416), den institutionellen Fonds von IST Austria, NÖ Forschung und Bildung n[f+b] life science call grant (C13-002) gefördert, das Human Frontiers Science Program (RGP0053/2014), das People-Programm (Marie-Curie-Maßnahmen) des Siebten Rahmenprogramms der Europäischen Union (FP7/2007-2013) im Rahmen der REA-Grant Nr. 618444 und vom Europäischen Forschungsrat im Rahmen des Forschungs- und Innovationsprogramms Horizont 2020 der Europäischen Union (Grant Nr. 725780 LinPro).
Tierwohl
Um zu verstehen, wie das menschliche Gehirn Information abspeichert und verarbeitet, ist es unumgänglich das Gehirn von Tieren während bestimmter Verhaltensweisen zu untersuchen. Keine anderen Methoden, wie z. B. in vitro oder in silico-Modelle, stehen hierfür als Alternative zur Verfügung. Die Tiere wurden gemäß der strengen in Österreich geltenden gesetzlichen Richtlinien aufgezogen, gehalten und behandelt.



