27. November 2024
Alles eine Frage der Zeit
Forschung am ISTA zeigt: Die Entwicklung von Gewebe ist zeitlich organisiert
In der Entwicklung von Wirbeltierembryos entsteht vieles von selbst. So organisiert sich eine Gruppe von Zellen etwa zum Neuralrohr – eine Struktur, aus der schließlich das Gehirn und das Rückenmark hervorgehen. Dazu sind bestimmte Signale erforderlich. Wie diese Signale aber von den sich entwickelnden Zellen interpretiert werden, war bisher unklar. Ein Forscherteam am Institute of Science and Technology Austria (ISTA) hat nun Antworten – dank Miniatur-2D-Organen und gummiartigen Silikonformen.

Man blickt in den tiefen Wald. Grashalme, Blumen, Sträucher und Bäume, soweit das Auge reicht. Jede Pflanze hat eine bestimmte Form und Aufgabe. Sie alle wachsen aber durch das Sonnenlicht, welches in Form eines Gradienten durch das Blätterdach durchgefiltert wird. Die Gewebe in Wirbeltieren, auch die des Menschen, entwickeln sich auf sehr ähnliche Weise. Der Unterschied: der treibende Faktor ist nicht das Licht, sondern Signalmoleküle, sogenannte „Morphogene“.
Ein interdisziplinäres Forschungsteam am Institute of Science and Technology Austria (ISTA) hat nun neue Erkenntnisse über genau diese Morphogene im sich entwickelnden Neuralrohr – dem späteren Gehirn und Rückenmark – gewonnen. Mithilfe von im Labor hergestellten Organoiden – Miniaturgewebe, die das embryonale Rückenmark imitieren – konnten die Wissenschafter:innen die Dynamik der Morphogen-Signalübertragung während der Entwicklung des Rückenmarks beobachten und untersuchen. Das entsprechende Protokoll und die Ergebnisse wurden in Star Protocol sowie in Developmental Cell veröffentlicht.
Selbstorganisation in höhere Strukturen
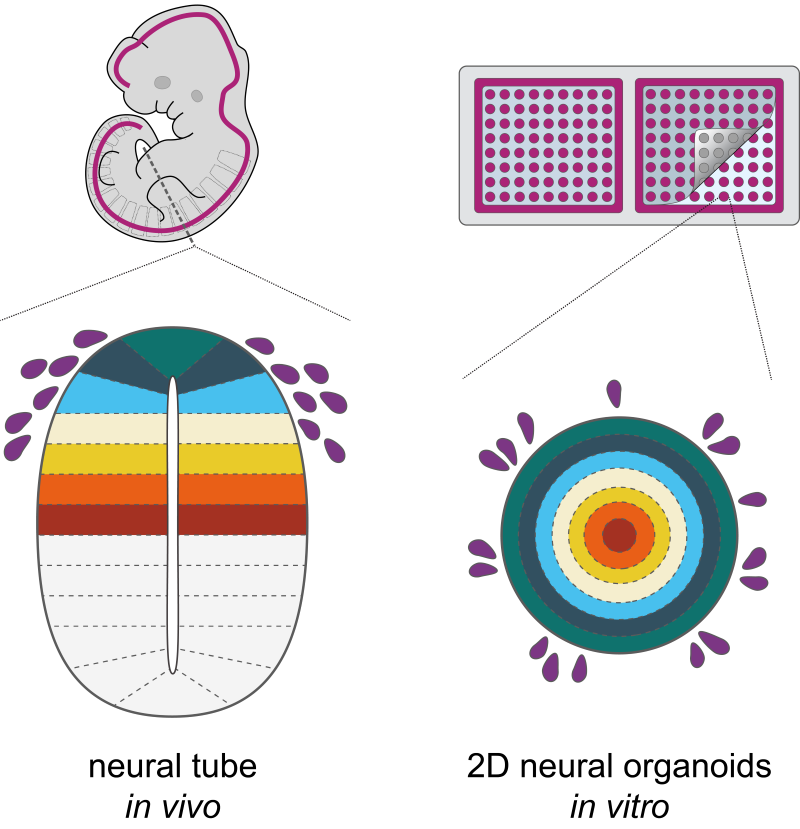
Morphogene werden in wachsenden Organen an bestimmten Stellen produziert und verbreiten sich dann im Gewebe. Dabei bilden sie einen Konzentrationsgradienten. Je nach Morphogen-Konzentration übernehmen die Zellen unterschiedliche Rollen und bilden selbstorganisierte Muster von Zelltypen, die der Struktur der reifen Organe zugrunde liegen. Genau das ist der Fall, wenn sich Stammzellen (Vorläuferzellen) in das Neuralrohr eines sich entwickelnden Embryos verwandeln.
Morphogene wie zum Beispiel „BMPs“ (Bone morphogenetic proteins) und sogenannte „Wnts“ sind hier die treibenden Signale zur Bildung neuer Muster. „Unklar ist es jedoch, wie diese Morphogene Signalgradienten in wachsenden Geweben bilden“, so Anna Kicheva. „Um zu verstehen, wie sich das gesamte Gewebe entwickelt, muss man mehr darüber herausfinden, wie die Morphogenproduktion reguliert wird.“
Stefanie Lehr, Doktorandin in Kichevas Forschungsgruppe, nahm sich dieser Frage an. „Es ist sehr schwer, den Entwicklungsprozess des Neuralrohrs im Embryo zu untersuchen, da man das Gewebe zu bestimmten Zeiten an bestimmten Stellen manipulieren muss“, erklärt Lehr.
Fachwissen teilen
„Zuerst generierten wir Vorläuferzellen des Rückenmarks und behandelten diese anschließend mit BMP“, so Lehr weiter. „Überraschenderweise verwandelten sich die Zellen nach Zugabe von BMP in alle verschiedenen Zelltypen des dorsalen Rückenmarks und organisierten sich wunderschön in einem geordneten Muster. Dieses Muster veränderte sich im Laufe der Zeit auf eine bestimmte Art und Weise – ganz wie im echten Gewebe.“ Aber wie kommt das? Was ist der Mechanismus dahinter? „Als wir das beobachteten, wollten wir als Nächstes eine quantitative Methode entwickeln, mit der wir dieses Phänomen erklären konnten“, fügt sie hinzu. Für dieses Unterfangen waren zwei Dinge erforderlich: ein In-vitro-Ansatz (außerhalb des lebenden Organismus; in einer Petrischale), der die experimentelle Beobachtung erleichtert und reproduzierbar macht, und das theoretische Fachwissen, um ein solch komplexes System zu analysieren. Letzteres wurde von den ISTA-Kollegen Edouard Hannezo und David Brückner bereitgestellt, die sich beide aus theoretischer Sicht mit Selbstorganisation und Entwicklung befassen. Für den In-vitro-Ansatz arbeiteten Lehr und ihre Kolleg:innen mit Jack Merrin zusammen, einem Staff Scientist in der Nanofabrication Facility (NFF) des ISTA.

Miniatur-2D-Organe in einem flexiblen Käfig
Für ihren experimentellen Ansatz entschieden sich die Wissenschafter:innen für Organoide. Das sind vereinfachte Versionen von Organen, die in einer Petrischale hergestellt werden und die die gleichen Hauptmerkmale aufweisen wie ihre Gegenstücke im lebenden Organismus. Dafür benötigt man Stammzellen. Um diese aber reproduzierbar zu Organoiden zu züchten, die eine ähnliche Zellorganisation wie das eigentliche Neuralrohr aufweisen, waren geometrische Beschränkungen erforderlich. „Konventionelles Mikromodellieren in der Petrischale kam für uns nicht in Frage, da die Zelltypen, die wir erzeugten, beweglich sind und sich schnell vermehrten“, eklärt Lehr.
Gemeinsam mit Jack Merrin entwickelten die Wissenschafter:innen ein Schablonensystem. Sie nutzten dafür die Photolithographie – ein System, bei dem mithilfe von Licht ein Muster auf einem Substrat erzeugt wird – um eine Form herzustellen. Diese Form wurde dann zur Herstellung der Schablonen verwendet – gummiartige Silikonplatten mit kleinen Löchern. Nach dem Aufbringen auf eine Petrischale wurden die Stammzellen in den Löchern gezüchtet und bildeten Organoide. Die Schablonen wurden anschließend entfernt, um das Wachstum der Kolonien, die Zellbewegung und die Entwicklung des Neuralrohrs zu ermöglichen und so die natürlichen Bedingungen im Embryo zu imitieren.
„Diese Methode bietet uns die spannende Möglichkeit, Gewebewachstum und Musterbildung mit Organoiden quantitativ zu untersuchen“, fügt Kicheva begeistert hinzu.
Auftauchen und wieder Verschwinden
Mit diesem Schablonenansatz untersuchten die Wissenschafter:innen die Rolle von BMP bei der Selbstorganisation. Dabei stellten die Forschenden fest, dass es im Organoid von Anfang an einen BMP-Morphogen-Signalgradienten gibt. Interessanterweise entsteht dieser Gradient schnell, verschwindet dann wieder, um dann erneut aufzutauchen. Eine ähnliche Dynamik tritt höchstwahrscheinlich auch im Embryo auf.
Um den zugrundeliegenden Mechanismus zu entschlüsseln, formulierten Hannezo und Brückner ein mathematisches Modell. Die theoretische Analyse in Verbindung mit der experimentellen Validierung zeigte, dass dieses Verhalten durch miteinander verknüpfte negative und positive Rückkopplungsschleifen gesteuert wird, die auf unterschiedlichen Zeitskalen wirken.
Zu Beginn reagieren die Zellen, insbesondere in der Peripherie, sehr empfindlich auf BMP, und es entsteht ein Signalgradient. Dieser frühe Gradient induziert einerseits Inhibitoren, die ihn schnell abschalten (negative Rückkopplung). Andererseits aktiviert der frühe Gradient auch Lmx1a – ein wichtiges Protein für die Entwicklung des Neuralrohrs. Lmx1a aktiviert dann langsam BMP und bewirkt, dass der BMP-Gradient wieder auftritt (positive Rückkopplung). Dieser späte Gradient von BMP-Signalen treibt dann die weitere Spezialisierung der Zelltypen an. Dieser Mechanismus ermöglicht nicht nur die Wiederverwendung des Signalwegs im Laufe der Zeit, sondern hilft auch bei der zeitlichen Abstimmung nachfolgender Entwicklungsereignisse.
Entwicklung ist zeitlich organisiert
Bisher ging man davon aus, dass die Konzentration von Morphogenen das Schicksal einer Zelle während der Entwicklung bestimmt. Diese Studie liefert nun Beweise dafür, dass die zeitlichen Veränderungen und nicht die absoluten Konzentrationen entscheidend sind, um zu verstehen, wie Zellschicksale in Geweben organisiert werden. Einfach ausgedrückt: Es geht nicht um die Menge eines Auslösers, sondern darum, wie er sich im Laufe der Zeit entwickelt.
„Ein einfacher Auslöser (hier: BMP) kann eine komplexe Reaktion hervorrufen, bei der ein Gradient im Gewebe selbst erzeugt wird, welcher einer komplexen zeitlichen Dynamik folgt. Das entspricht im Wesentlichen der Art von Reaktion, die die Basis für die Fähigkeit von Embryonen und Organoiden zur Selbstorganisation bildet“, erklärt Kicheva.
Wie sich Zellen zu funktionalen Organen organisieren, ist eine der grundlegenden Fragen der Entwicklungs- und Stammzellbiologie. Darüber hinaus ist sie auch von medizinischer Bedeutung, vor allem im Hinblick auf die Weiterentwicklung der regenerativen Medizin und des Tissue Engineerings – zwei Bereiche der angewandten Wissenschaft, die sich darauf konzentrieren, geschädigtes oder krankes Gewebe durch funktionales Gewebe zu ersetzen.
Publikationen:
S. Lehr, D. Brückner, T. Minchington, M. Greunz-Schindler, J. Merrin, E. Hannezo, A. Kicheva. 2024. Self-organized pattern formation in the developing neural tube by a temporal relay of BMP signaling. Dev Cell. DOI: 10.1016/j.devcel.2024.10.024
S. Lehr, J. Merrin, M. Kulig, T. Minchington, A. Kicheva. Fabrication of elastomeric stencils for patterned stem cell differentiation. 2024. Star Protocol. DOI: 10.1016/j.xpro.2024.103187
Projektförderung:
Die Arbeit im Kicheva Labor wurde mit Mitteln des European Research Council im Rahmen von Horizon Europe 101044579 und des Österreichischen Wissenschaftsfonds (FWF) unterstützt: Grant DOI 10.55776/F78. S. Lehr wurde von der Gesellschaft für Forschungsförderung Niederösterreich m.b.H. mit dem Stipendium SC19-011 unterstützt. D. Brückner wurde von der NOMIS Foundation als NOMIS Fellow und durch ein EMBO Postdoctoral Fellowship (ALTF 343-2022) unterstützt.



