16. März 2021
Embryonales Gewebe zwischen fest und flüssig
Wissenschafter_innen erklären eine entscheidende Phase der Embryonalentwicklung beim Zebrafisch mit Hilfe mathematischer und physikalischer Konzepte.

Bei der Untersuchung von Zebrafischembryos beobachteten Wissenschafter_innen am Institute of Science and Technology (IST) Austria eine abrupte und drastische Veränderung: Innerhalb weniger Minuten verflüssigt sich das relativ feste Gewebe. Was führt dazu und welche Rolle spielt diese Veränderung bei der weiteren Entwicklung des Embryos? In einer multidisziplinären Studie veröffentlicht in der Fachzeitschrift Cell, fanden sie Antworten, die unseren Blick auf wichtige Entwicklungsprozesse und metastasierende Krebstumoren verändern könnte.
Um mehr darüber zu erfahren, wie sich ein winziger Zellhaufen zu komplexen Systemen wie Fischen, Menschen oder Tieren so groß wie Elefanten entwickelt, wenden sich Forschende an den Zebrafisch (Danio rerio). Er hat einige Vorteile, die ihn zu einem der beliebtesten Modellorganismen von Entwicklungsbiolog_innen wie Nicoletta Petridou machen, bis vor kurzem Postdoktorandin in der Forschungsgruppe von Carl-Philipp Heisenberg am Institute of Science and Technology (IST) Austria. Die kleinen gestreiften Fische entwickeln sich innerhalb weniger Tage, die Embryonen tun dies außerhalb ihrer Mütter und sind transparent – man kann den Organen also beim Wachsen zusehen. Bei der Untersuchung von Zebrafischembryos entdeckten Nicoletta Petridou und ihre Kollegen in einer früheren Studie eine plötzliche Veränderung der Viskosität des Gewebes – ein Maß für die Verformungsresistenz eines Materials: „In diesem frühen Stadium ist das Gewebe, das den Embryo bildet, sehr starr, aber plötzlich sinkt die Viskosität um das Zehnfache und das Gewebe verflüssigt sich“, erklärt die Biologin.

Kleine Veränderung – großer Effekt
Gleichzeitig beginnt der Embryo sich zum ersten Mal deutlich zu verändern. Diese Phase wird Morphogenese genannt. In ihrer neuen Studie haben sich die Forscher_innen genauer angesehen, was auf zellulärer Ebene passiert während sich das Gewebe verflüssigt. „Vor diesem Übergang von fest zu flüssig ist eine einzelne Zelle mit vier bis fünf benachbarten Zellen verbunden. Zu Beginn der Verflüssigung hat sie nur mehr drei bis vier Nachbarn“, sagt Petridou. Könnte diese kleine Veränderung in der Vernetzung der Zellen wirklich für eine zehnfache Veränderung der Viskosität des Gewebes verantwortlich sein? „Das war der Zeitpunkt, als wir uns an die Physik gewandt haben, um diese Effekte mithilfe eines physikalischen Konzepts zu erklären“, so die Molekular- und Entwicklungsbiologin.

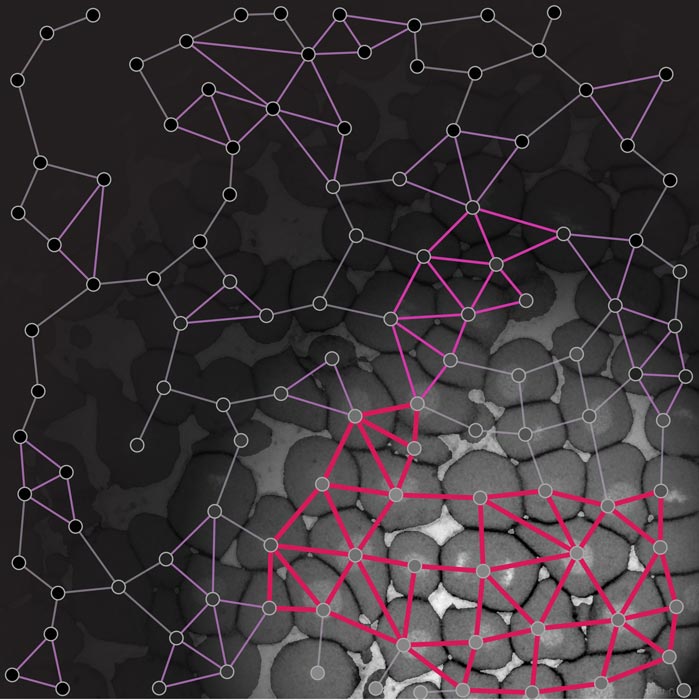
„Nicoletta hat also diesen massiven Abfall der Gewebeviskosität auf makroskopischer Ebene beobachtet, der offenbar nicht zu dem passt, was auf der mikroskopischen Ebene vor sich geht. Das ist ein zentraler Punkt der Physik: das, was auf der mikroskopischen Ebene passiert, mit der makroskopischen Ebene zu verbinden“, sagt Bernat Corominas-Murtra, bis vor kurzem Teil der Forschungsgruppe von Edouard Hannezo. Mittels eines Konzepts der Materialwissenschaft erkannte das Team, dass jede Zelle, die mit vier Nachbarzellen verbunden war, eine ganz besondere Grenze markiert: Bereits im 19. Jahrhundert stellte der Physiker James Clerk Maxwell fest, dass Strukturen wie etwa Brücken unterhalb eines bestimmten Levels von Verbindungen nicht mehr starr sein können. Das passte genau zu der experimentell beobachteten Verflüssigung des Gewebes, die auftritt, wenn Zellen mit weniger als vier Nachbarn verbunden sind. Damit konnte das Team zeigen, dass die Verflüssigung des Gewebes Merkmale eines Phasenübergangs aufweist, also dem Übergang von einem Aggregatzustand wie fest, flüssig oder gasförmig in einen anderen.

Ein kritischer Punkt
Auch wenn die Forschenden das Gewebe beliebig manipulierten, reichte der kritische Punkt der Verbindungen aus, um die beobachteten abrupten Änderungen der Gewebeviskosität zu erklären. Außerdem konnten sie alle theoretisch zu erwartenden Merkmale eines Phasenübergangs, wie er in nicht-lebenden Systemen vorkommt, nachweisen. „Es ist einzigartig, alle erwarteten Eigenschaften eines Phasenübergangs in einem realen, lebenden System nachweisen zu können. Vor allem, weil die Phasenübergangstheorie für Systeme mit einer Milliarde Komponenten gemacht ist, während wir hier über ein System mit ein paar hundert Komponenten sprechen“, erklärt Corominas-Murtra begeistert.
Zugehöriges Video auf YouTube ansehen
Ein Zeitraffer des Rigiditätsnetzwerks eines Zebrafischembryos basierend auf der Rigiditäts-Perkolationstheorie. Die abrupte Verringerung der Größe des größten Rigiditätsclusters (lila) markiert den Phasenübergang von fest zu flüssig am Beginn der Morphogenese. © Nicoletta Petridou, Bernat Corominas-Murtra, IST Austria
Doch, wenn der Verlust von nur einer Verbindung pro Zelle ausreicht, um eine so signifikante Veränderung des Gewebes des Embryos auszulösen, wie wird dann eine zufällige Veränderung zur falschen Zeit vermieden? „Jetzt, da wir wissen, dass es einen kritischen Punkt gibt, können wir fragen, was sein Gleichgewicht reguliert. Eine der Regulierungen, die wir gefunden haben, ist das Timing der Zellteilungen, das reguliert, wie sich die Gewebekonnektivität und damit die Viskosität in Raum und Zeit verändert“, so Petridou, die gerade ihre eigene Forschungsgruppe am Europäischen Laboratorium für Molekularbiologie (EMBL) in Heidelberg, Deutschland, gegründet hat.
Von Fischembryonen zur Krebsforschung
Dieser Phasenübergang im Gewebe ist essentiell für die weitere Entwicklung des winzigen Fischembryos, scheint aber auch beim Wachstum von Krebszellen eine Rolle zu spielen. Neueste Studien zeigen, dass wenn ein Tumor metastasiert, sich das Gewebe ebenfalls abrupt von fest zu flüssig verändert. Das könnte Krebszellen dabei helfen, sich leichter zu bewegen. „Wenn man diesen kritischen Punkt ermitteln kann, eröffnet das Wege, ihn zu manipulieren“, sagt Petridou. „Wir haben noch nicht die Werkzeuge dafür, aber anstatt sich konzeptionell auf eine Vielzahl von Genen zu konzentrieren, die beim Krebswachstum eine Rolle spielen könnten, könnte man bei dem kritischen Punkt ansetzen, der die Gewebeveränderung auslöst.“
Ausschlaggebend für den Erfolg des Projekts, war die Zusammenarbeit von Forscher_innen aus zwei verschiedenen Forschungsgruppen am IST Austria. „Ich erinnere mich, dass ich Stunden im Labor mit Nicoletta verbracht habe, um herauszufinden, was sie eigentlich tut und umgekehrt. Wir mussten eine gemeinsame Sprache finden, was viel Zeit in Anspruch nimmt, aber sehr lohnend ist. Multidisziplinarität ist eine Haltung“, ist Bernat Corominas-Murtra überzeugt. Seit kurzem ist er Assistenzprofessor an der österreichischen Karl-Franzens-Universität Graz.
Publikation
Nicoletta I Petridou, Bernat Corominas-Murtra, Carl-Philipp Heisenberg & Edouard Hannezo. 2021. Rigidity percolation uncovers the structural basis of embryonic tissue phase transitions. Cell. https://doi.org/10.1016/j.cell.2021.02.017
Projektförderung
Dieses IST Austria Projekt wurde mit Mitteln des Elise-Richter-Programms des österreichischen Wissenschaftsfonds FWF für Nicoletta Petridou (V 736-B26) und des Europäische Forschungsrates mittels einem ERC Advanced grant für Carl-Philipp Heisenberg (742573) und einem ERC Starting grant für (851288) Edouard Hannezo finanziert.



